Editované ledviny, odmítnuté nádory, komáří očkování a AI protijedy – „jednohubky“ z výzkumu 2025/2
Dnešní porce „jednohubek“ z výzkumu nabízí řadu pozoruhodných novinek z pomezí veterinární a humánní medicíny: vedle xenotransplantací jsou prasata nově v centru zájmu i pro své specifické sacharidy; protijedy na hadí uštknutí pro změnu nově začala vyvíjet umělá inteligence a jako třešničku na závěr jsme si nechali komáry namísto očkujících zdravotníků. Nechte si chutnat!

Umělá inteligence navrhuje protijedy na hadí uštknutí
Program RFDiffusion, který s pomocí algoritmů umělé inteligence navrhuje nové proteiny, dokázal navrhnout několik malých proteinů, tzv. mini-binders, schopných neutralizovat neurotoxiny obsažené v jedu korálovcovitých. Do této čeledi patří obzvláště jedovatí tropičtí hadi, například mamba či kobra. Navržené proteiny rozpoznávají klíčové oblasti na tzv. tříprstých toxinech, což jsou krátké proteiny obsažené v hadím jedu, jež poškozují tkáně a inhibují acetylcholinové receptory. V současné době je jedinou možností léčby hadího uštknutí podání antiséra − souboru polyklonálních protilátek získaných z krevní plazmy imunizovaných zvířat. V klinickém vývoji jsou i přesněji cílené monoklonální protilátky. Tato antiséra však vyžadují skladování v chladu a podání školeným personálem.
Vědci zatím testovali mini-binders na laboratorních myších s velmi dobrým výsledkem. Myším však podávali jen ty neurotoxické složky hadího jedu, na něž testované proteiny cílily. Pro přenos do klinické praxe bude nutno vyvinout ještě blokátory fosfolipázových toxinů, které jed taktéž obsahuje. Použitelný protijed by měl být koktejlem inhibičních proteinů, jehož složení bude dáno obvyklým výskytem daných druhů jedovatých hadů v oblasti jeho použití. Mini-binders jsou velmi stabilní, což by mohlo umožnit jejich uchovávání při pokojové teplotě. Navíc by mohly být relativně levně vyráběny pomocí bakterií v průmyslových bioreaktorech. Zdá se nicméně, že hlavní překážkou v dalším vývoji bude přesto zejména nedostatek financí – ochotných sponzorů výzkumu léčiv opomíjených tropických nemocí je totiž pomálu.1, 2

Transplantace porcinní ledviny 62letému diabetikovi
V New England Journal of Medicine byla v únoru 2025 publikována kazuistika muže s konečným stadiem selhání ledvin, u něhož byla úspěšně transplantována porcinní ledvina. Xenotransplantace by mohly pomoci řešit kritický nedostatek ledvin od lidských dárců. Pokroky v genovém editování pomocí nástroje CRISPR-Cas9 umožnily již 2leté přežití primátů po transplantaci porcinní ledviny.
62letému muži závislému na hemodialýze, s dlouhodobým diabetem, pokročilou vaskulopatií a problémy s cévním přístupem pro provádění dialýzy byla transplantována porcinní ledvina po 69 genomových editacích včetně delece 3 glykanových antigenů, inaktivace porcinních endogenních retrovirů a inzerce 7 lidských transgenů. Xenoštěp začal po tranplantaci ihned fungovat. Pacientovi rychle klesla hladina kreatininu a nadále nepotřeboval dialýzu. 8. den se začala rozvíjet rejekce štěpu zprostředkovaná T lymfocyty, která byla odvrácena intenzifikovanou imunosupresí. I přes fungující ledvinu pacient po 52 dnech zemřel v důsledku náhlé srdeční smrti, aniž by došlo k rejekci ledviny. Pitva prokázala těžkou ICHS s jizvou v oblasti myokardu.3

Jak přimět imunitní systém zaútočit na nádor? Zkoušejí se prasečí cukry
Autoři čerstvě publikovaného výzkumu vyvinuli virus, který je schopen označit nádorovou tkáň prasečími sacharidy a spustit tak reakci analogickou odmítnutí transplantovaného orgánu. Zkombinovali při tom onkolytický virus newcastleské choroby (pseudomor drůbeže), který sám o sobě není schopen vyvolat dostatečně silnou imunitní odpověď proti nádoru, s genem pro α-1,3-galaktosyltransferázu. Tento enzym tvoří sacharidy odvozené od galaktózy, jež jsou přítomné na povrchu prasečích buněk a jsou zodpovědné za bouřlivou imunitní reakci při odmítnutí prasečího orgánu lidským příjemcem.
Terapie modifikovaným virem se osvědčila u makaků s nádorem jater. Proto byla provedena pilotní studie, v jejímž rámci byl virus podán intravenózní nebo intraperitoneální infuzí 23 pacientům v terminálním stadiu nádorového onemocnění. Spektrum nádorů bylo velmi široké – jednalo se o onemocnění jater, jícnu rekta, kůže, plic, vaječníků, prsu a cervixu. Po 2 letech sledování dosáhli 2 pacienti částečné odpovědi na léčbu, u 5 bylo onemocnění stabilní, pouze u 2 nemocných nenastal žádný přínos a u zbytku došlo k počáteční odpovědi či stabilizaci onemocnění a následné progresi. Vědci nyní plánují provést další studie s větším počtem účastníků.4, 5
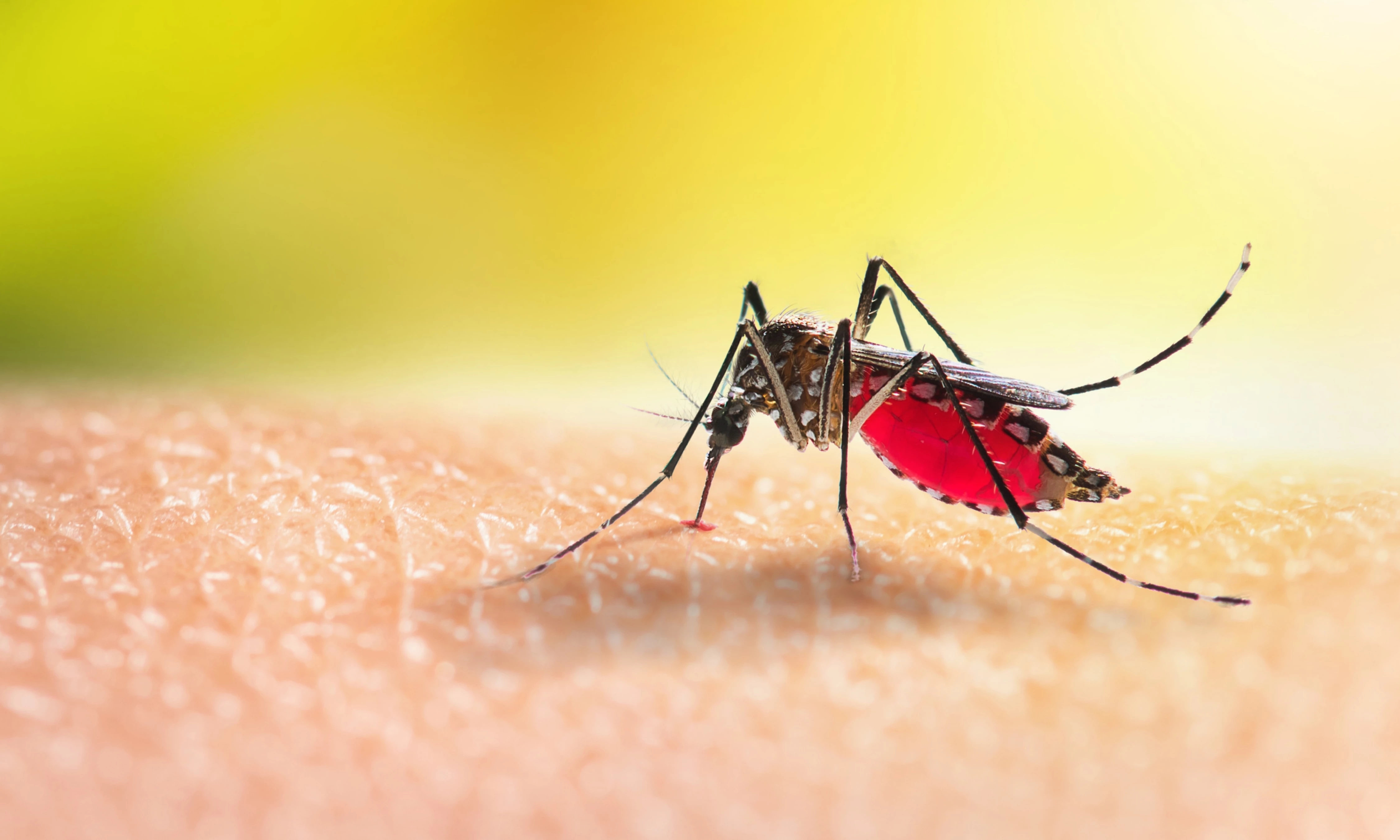
Komáři očkují proti malárii
Nizozemští vědci vyvinuli novou vakcinační strategii proti malárii. Využili při tom komáry nakažené geneticky modifikovaným původcem tohoto onemocnění.
Malárii způsobuje nitrobuněčný prvok zimnička tropická (Plasmodium falciparum) − po přenosu z nakaženého komára infikuje nejprve hepatocyty lidského hostitele a poté červené krvinky. Nejtypičtější příznak onemocnění, malarická horečka, vzniká v důsledku rozpadu napadených erytrocytů a uvolnění parazita a jeho odpadních látek do krevního oběhu.
Kmen P. falciparum GA2 použitý pro vakcinaci byl navržen tak, aby se jeho vývoj zastavil přibližně po 6 dnech po infekci, a prvok tak nedokázal přecházet z jaterního do krevního stadia. V malé pilotní studii u 10 zdravých dobrovolníků, kteří byli očkováni 50 kousnutími nakažených komárů, poskytla expozice modifikované zimničce ochranu před infekcí po kousnutí komárem nakaženým malárií u 8 z 9 hodnocených probandů. Nejčastějšími nežádoucími příhodami byly otok a svědění v místě komářích kousnutí, u několika pacientů se vyskytla mírná bolest svalů nebo hlavy. Vědci se nyní budou snažit provést klinickou studii s větším počtem účastníků.6, 7
(este, zza)
Zdroje:
1. Vázquez Torres S., Benard Valle M., Mackessy S. P. et al. De novo designed proteins neutralize lethal snake venom toxins. Nature 2025 Jan 15, doi: 10.1038/s41586-024-08393-x [Epub ahead of print].
2. Callaway E. AI-designed proteins tackle century-old problem − making snake antivenoms. Nature 2025 Jan; 637 (8047): 776, doi: 10.1038/d41586-025-00133-z.
3. Kawai T., Williams W. W., Elias N. et al. Xenotransplantation of a porcine kidney for end-stage kidney disease. N Engl J Med 2025 Feb 7, doi: 10.1056/NEJMoa2412747 [Epub ahead of print].
4. Zhong L., Gan L., Wang B. et al. Hyperacute rejection-engineered oncolytic virus for interventional clinical trial in refractory cancer patients. Cell 2025 Feb 20; 188 (4): 1119–1136.e23, doi: 10.1016/j.cell.2024.12.010.
5. Sidik S. How to trick the immune system into attacking tumours. Nature 2025 Jan 17, doi: 10.1038/d41586-025-00126-y [Epub ahead of print].
6. Lamers O. A. C., Franke-Fayard B. M. D., Koopman J. P. R. et al. Safety and efficacy of immunization with a late-liver-stage attenuated malaria parasite. N Engl J Med2024 Nov 21; 391 (20): 1913–1923, doi: 10.1056/NEJMoa2313892.
7. Kudiabor H. This malaria vaccine is delivered by a mosquito bite. Nature2024 Nov 20, doi: 10.1038/d41586-024-03817-0 [Epub ahead of print].
Líbil se Vám článek? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
- Nová doporučení WSAVA ohledně vakcinačních schémat u psů a koček – prakticky a v kostce
- Perorální antiemetikum s obsahem maropitantu k prevenci a léčbě zvracení u psů
- Top 5 nejčastějších poranění svalů a šlach u psů
- Jak na kolaps trachey u psů?
- Angiostrongylózu u psů lze lehce zaměnit za jiná onemocnění. Jak si s ní poradit?
